پوست و مو
بیماریهای پوستی-درمانهای هدفمند
بیماریهای پوستی-درمانهای هدفمند
با ظهور درمانهای جدید، خصوصا درمانهای هدفمند، امیدهای زیادی در درمان بیماریهای صعبالعلاجی مانند بازال سل کارسینومای پیشرفته، پسوریازیس و ملانومای متاستاتیک پیدا شده، به طوری که میتوان ادعا کرد رویکرد درمانی به این بیماریها تغییر کرده و اکنون به بیماریهای قابل درمان مبدل شدهاند. در طول سالیان گذشته، درمانهای هدفمند بهطور قابل توجهی پیامدهای بیماران مبتلا به بیماریهای غیرقابل علاج را تغییر دادهاند. در این مقاله، سعی بر آن است تا به معرفی چندی از آنها پرداخته و چالشهای موجود را در این زمینه، همچنین عوارض جانبی و کاربرد بهینه آنها را معرفی کنیم. درمانهای هدفمند جدید چگونگی رویکرد بالینی را به بیماران مبتلا به بیماریهای درماتولوژیک و درمان آنها دچار تغییرات عظیمی کرده است. تکنیکهای بیولوژی ملکولار نوآورانه که از دهه ۱۹۷۰ معرفی شدهاند، بینش فوقالعادهای را به سوی پاتوژنز سلولی و ملکولی بیماریهای متعددی به وجود آورده است. داروهای جدیدی که بر این اساس ابداع شدهاند، میوه این درمانهای بیولوژیک مستقیم هستند که انقلابی در کار بالین ایجاد کرده و به طور ورزافزونی نیز در دسترس قرار میگیرند.
درمانهای هدفمند در درمان پسوریازیس وولگاریس
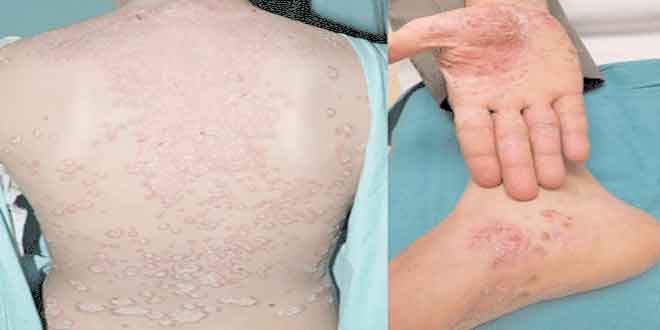
معرفی مورد: بیمار، خانم ۲۸ سالهای است که مبتلا به پسوریازیس بدترشونده است. در حدود ۳۵ درصد از سطح بدن وی، شامل کف دست و پا، درگیر بوده، به طوریکه در انجام فعالیتهای روزانه خود با مشکلات متعددی روبرو شده است. به نظر شما، گزینههای درمانی این بیمار کدامند؟
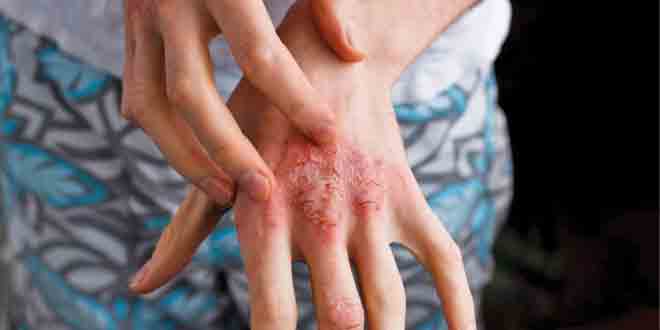
شرح عکس: درگیری گسترده تنه همراه با پلاک پسوریازیس و درگیری کف دست و پا با palmoplantar pustulosis در یک خانم ۲۸ ساله.
پسوریازیس، یک بیماری مزمن با واسطه ایمنی است که ۳ درصد افراد را در کل دنیا تحت تاثیر قرار میدهد. در فرمهای متوسط تا شدید این بیماری، پسوریازیس یک بیماری التهابی سیستمیک در نظر گرفته میشود که ممکن است ارگانهای بدن را متفاوت از پوست درگیر کند. بیماریهای کوموربید مرتبط با آن که شایع هستند، عبارتند از آرتریت پسوریاتیک التهابی، بیماری قلبیعروقی، بدخیمیها (مانند لنفوم)، و بیماری التهابی روده. علاوه براین، کیفیت زندگی بیماران نیز بهطور قابل توجهی مختل میشود، زیرا اعتماد به نفس آنها دچار اختلال شده، انگی به آنها زده میشود که ارتباطهای اجتماعی و کاری آنها را متاثر میکند، و تا ۶۰ درصد موارد، بیماران دچار افسردگی بالینی میشوند. حمله آرتریت پسوریاتیک، خصوصا نوع تخریبی آن، نقطه عطف تصمیمگیری درمانی برای شروع درمانهای تهاجمی است، زیرا تخریب مفصل قابل بازگشت نیست.
مهارکنندههای TNF alpha، اینترلوکین ۱۲ و ۲۳: سازمان غذا و داروی آمریکا، نخستین داروهای موثر و هدفمندی را که در درمان پسوریازیس مورد تائید قرار داد، مهارکنندههای TNF alpha و مهارکنندههای اینترلوکین ۱۲ و ۲۳، با نام ustekinumab بودند. Etanercept، نخستین مهارکننده TNF alpha بود که در دسترس قرار گرفت و در سال ۲۰۰۴ برای درمان پسوریازیس متوسط تا شدید تائید شد. در سال ۲۰۰۸، ustekinumab برای همان اندیکاسیون تائیدیه خود را از FDA دریافت کرد. این داروها موثر و عموما ایمن هستند و انقلابی را در درمان پسوریازیس و آرتریت پسوریاتیک ایجاد کردهاند و اکنون به صورت روزانه تجویز میشوند. نکته مثبت دیگر این داروها، افزایش قابل توجه کیفیت زندگی بیماران، حداقل در ۷۵ درصد موارد است. در اوایل دهه ۲۰۰۰، زمانی که سلولهای Th-17 کشف شدند، اصل و نسب جدیدی از سلولهای T متمایز از سلولهای Th1 و Th2 کشف شدند. Th-17، با تولید IL-17 کار خود را انجام میدهند. IL-17، یک سیتوکین پیش التهابی است با ۶ عضو خانواده (IL-17A تا IL-17F). در طول سالیان اخیر، تحقیقات نشان داده که سلولهای Th-17 و IL-17A نقش مهمی در اختلال در نظم ایمونولوژیک پسوریازیس بازی میکنند. بنابراین این ایده مطرح است که جایگزینی سلولهای Th-17 و IL-17A با سلولهای Th-1 و سیتوکاینهای مرتبط به عنوان مدیاتورهای اصلی در صدمه بافتی، پاتوژنز اصلی پسوریازیس را تشکیل میدهند. این ایده، یافتههای جدیدی را برای درمان این بیماری نیز نشان داده است.
۳ نوع آنتیبادی مونوکلونال که مهار IL-17 را هدف قرار میدهند، در حال حاضر تحت بررسی هستند. Secukinumab و ixekizumab به IL-17A متصل شده و آن را از سیگنالدهی منع میکند. در حالی که، brodalumab به گیرنده IL-17A باند شده و تمامی ۶ عضو خانواده IL-17 را مهار میکند. کارآزماییهای بالینی که تاکنون در زمینه مهارکنندههای IL-17 انجام شدهاند، همگی حاکی از بهبود قابل توجه ضایعات پوستی در بیماران مبتلا به پسوریازیس بوده است.
عوارض جانبی: در اغلب موارد، مهارکنندههای IL-17 عوارض جانبی مختصری داشته و مشابه مواردی بوده که با درمانهای بیولوژیک در دسترس برای درمان پسوریازیس رخ میدهند. شایعترین عوارض جانبی که گزارش شده، عبارتند از نازوفارنژیت، عفونت دستگاه تنفسی فوقانی، آرترالژی، و واکنشهای خفیف در محل تزریق. در آینده، باید به میزان بروز عفونتهای شناخته شده مرتبط با IL-17، خصوصا عفونتهای موضعی با استاف اورئوس و گونههای کاندیدا، بیشتر توجه کرد. بعضی بیماران، مبتلا به ازوفاژیت کاندیدایی مبتلا میشوند که با قطع دارو بهبود مییابند. نوتروپنی نیز رخ میدهد، اما تعداد بسیار اندکی از بیماران به درجه ۳ (۵۰۰ تا ۱۰۰۰ سلول در هر میلیمتر مکعب) یا وضعیت بدتر میرسند. تمامی عوارض جانبی با قطع درمان قابل بازگشت هستند.
secukinumab: در ۲۱ ژانویه ۲۰۱۵، سازمان غذا و داروی آمریکا secukinumab را برای درمان پسوریازیس وولگاریس متوسط تا شدید در بیماران بزرگسال تائید کرده و این دارو هماکنون با تجویز پزشک در دسترس قرار میگیرد. البته مطالعات بیشتری نیز در زمینه بررسی مهارکنندههای IL-17 برای درمان پسوریازیس و آرتریت پسوریاتیک در دست انجام است و تا زمان نگارش این مقاله، فازهای مختلف آنها به سرانجام رسیدهاند.
درمان هدفمند در ملانومای پیشرفته
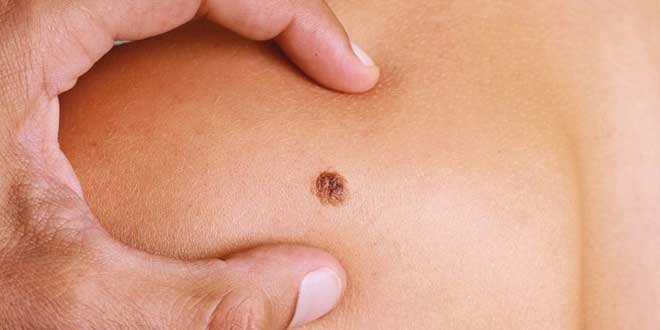
معرفی مورد: آقای ۵۸ سالهای با ضایعات پیگمنته نامنظم روی پشت مراجعه کرد. نتایج بیوپسی، حاکی از بروز ملانومای بدخیم با ارتشاح التهابی مزمن و شدید در اطراف تومور بود. تومور به روش جراحی و با حاشیه استاندارد برداشته شد. دو سال بعد، بیمار مبتلا به ضایعات متعدد پیگمنته روی صورت شده و از سردرد شکایت داشت. تصویربرداری با MRI از مغز بیمار، ضایعات متعدد تقویت شدهای را نشان میداد که با ملانومای متاستاتیک همخوانی داشتند. به نظر شما، گزینههای درمانی بیمار چه مواردی هستند؟ علیرغم دههها تحقیق، داروهای مورد تائید FDA که برای درمان ملانوما پیشرفته در دسترس هستند، تا همین اواخر، اندک بودهاند. داکاربازین، عامل آلکیله کننده، در سال ۱۹۷۵ تائید شد، اینترفرون آلفا در سال ۱۹۹۵، و دوز بالای اینترلوکین ۲ در سال ۱۹۹۸. هرچند بعضی بیماران به این داروها پاسخ درمانی میدهند، مطالعات بهبود قابل توجهی را در بقای بیماران تحت درمان با این داروهای تائید شده نشان ندادهاند.
در سال ۲۰۰۲، محققان دریافتند که ۵۰ تا ۶۵ درصد از بیماران مبتلا به ملانومای پوستی متاستاتیک موتاسیونی در ژن BRAF دارند. نکته جالب آنکه، ۸۰ درصد از این بیماران یک موتاسیون خاص و تکی را نشان میدادند: جایگزینی گلوتامیک اسید به جای والین در کدون ۶۰۰ (BRAF V600E). دومین موتاسیون شایع، جایگزینی لیزین به جای همان والین است (BRAF V600K). علاوه براین، NRAS هم در حدود ۲۰ درصد ملانومها موتاسیون یافته است. این یافتهها نشان دادهاند که در درصد زیادی از بیماران، یک راه پروتئین کیناز فعال شده با میتوژن، نقش حیاتی در ملانومای متاستاتیک بازی میکند. براساس این دانش به دست آمده، درمانهای هدفمند بسیاری برای درمان ملانوما ابداع شدهاند که بعضی از آنها نیز تائید شدهاند.
Vemurafenib: در سال ۲۰۱۰، محققان نتایج فاز ۱ و ۲ کارآزمایی بالینی Vemurafenib (960 میلیگرم، خوراکی، دو بار در روز)، یک مهارکننده قوی BRAF با موتاسیون V600E، را منتشر کردند. آنها نشان دادند که این دارو در ۸۰ درصد از بیماران مبتلا به مرحله ۴ ملانوما با موتاسیون BRAF، موثر است و باعث ایجاد پاسخ درمانی بیسابقهای شده که درهای امید را به روی تغییرات در درمان ملانومای متاستاتیک گشوده است. نتایج فاز ۳ این مطالعه در سال ۲۰۱۱ منتشر شد که مشخص کرد بیماران درمان شده با Vemurafenib، در مقایسه با گروهی که درمان استاندارد dacarbazine را دریافت کرده بودند، بقای بدون پیشرفت بیماری بالاتری را پشت سر گذاشتهاند (۳/۵ ماه در مقابل ۶/۱ ماه). براساس این نتایج، سازمان غذا و داروی آمریکا، Vemurafenib را در آگوست ۲۰۱۱ برای درمان بیماران مبتلا به ملانوما با موتاسیون BRAF تائید کرد.
Dabrafenib: در فاز یک کارآزمایی بالینی که در سال ۲۰۱۲ انجام شد، محققان داروی Dabrafenib را آزمایش کردند که نسل دوم مهارکننده BRAF بوده و بسیار قویتر. نیمی از بیماران به آن پاسخ داده و بهبود قابل توجهی در میزان بقای بدون پیشرفت بیماری آنها دیده شد. همین مطالعه، منجر به تائید Dabrafenib بوسیله سازمان غذا و داروی آمریکا در سال ۲۰۱۳ شد تا در درمان بیماران مبتلا به ملانوما با موتاسیون BRAF به کار گرفته شود. عوارض جانبی دو داروی فوق، عبارتند از راش، خستگی، تب و درد مفاصل. علاوه براین، تا ۲۵ درصد از بیماران مبتلا به کارسینومای سلول سنگفرشی پوستی متعدد ثانویه و کراتوآکانتوزیس شدند. این عوارض اغلب در ماههای اولیه درمان دیده شده که به نظر میرسد به دلیل فعال شدن متناقض راه MAPK باشد. البته درمانهای هدفمند دیگری نیز بررسی و تائید شدهاند که در شمارههای آینده در مورد آنها بحث خواهد شد